実験医学 研究内容
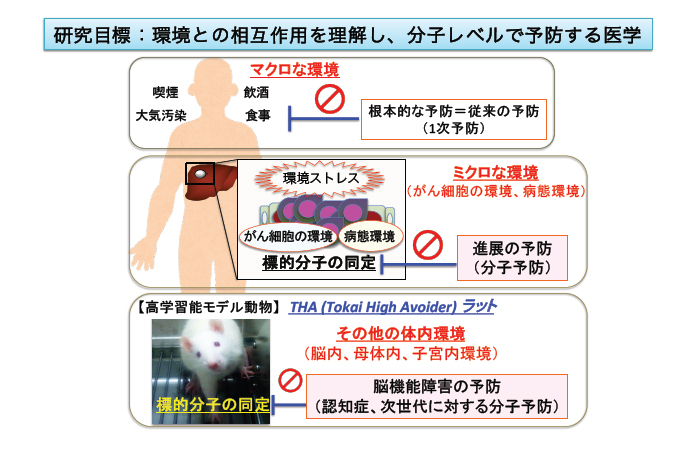
研究目標:環境との相互作用を理解し、分子レベルで予防する医学
実験研究責任者:遠藤 整 (researchmap : https://researchmap.jp/hit-endo)
私たちは、基礎医学、衛⽣学、環境医学の知⾒を融合し、⽣体と環境との相互作⽤を分⼦レベルで解明することを⽬指しています。衛⽣学・公衆衛⽣学において、最も重要な柱の⼀つは「⼀次予防」です。しかし、真に病気を予防・制御するには、その発症メカニズムを深く理解する必要があります。
病気の発症や⽣体応答は、環境因⼦との複雑な相互作⽤によって成⽴しています。その本質を分⼦・細胞レベルで解明し、病気の「予兆」を捉え、予防へとつなげることが、私たちの研究の中核です。
この⽬的のために、以下のような最先端の研究⼿法を統合的に活⽤しています:
- 分⼦⽣物学的、⽣化学的解析
- 全ゲノム解析・RNA-seq・プロテオーム・メタボロームによるマルチオミクス解析
- CRISPR等のゲノム編集技術(i-GONAD法)
- バイオインフォマティクスとマルチモーダルデータ解析
これらを組み合わせることで、新たな衛⽣学・予防医学の構築を⽬指しています。
主な研究テーマ
1. Tokai High Avoider (THA) ラットを活⽤した学際的医科学研究
THAラットは、Wistarラットをもとに、「レバー押し回避学習試験」において⾼い学習能⼒を⽰す個体を選抜・近交配することで確⽴された系統です。すでに143世代を超えており(2025 年7 ⽉時点)、世界的にも極めて希少な“⾼学習能モデル動物”です。(図1)
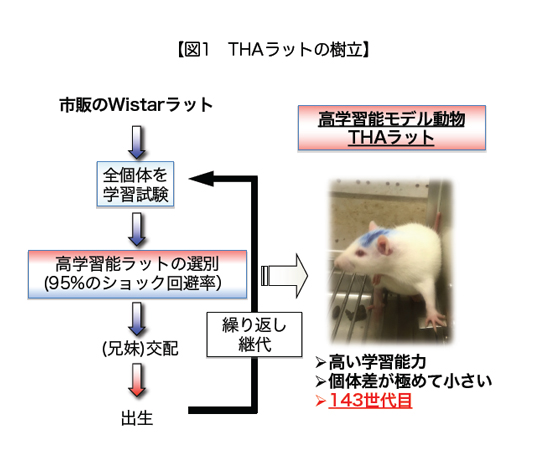
THAラットの⼤きな特徴は以下の通りです:
- ⽣まれながらにして⾼い学習能⼒を有し、個体差が⾮常に⼩さい
- 40年以上にわたり、進化的なフィードバックを通じて⾼学習能を固定化
- 遺伝⼦改変による代償的な副作⽤がなく、⾼次脳機能の研究に特化したモデル動物として理想的
このラットに刻まれたgenetic(遺伝的)・non-genetic(⾮遺伝的)情報を読み解くことで、「学習」「記憶」「可塑性」といった⾼次脳機能の本質に迫ることが可能と考えています。
また、化学物質の曝露が脳の発達や機能に与える影響を評価するうえでも、標準化された⾼学習能をもつTHAラットは有⼒なプラットフォームになります。精神・神経疾患の研究や創薬においても、新たな突破⼝を拓く可能性を秘めています。
代表的な研究テーマ:
- ① ⾼学習能を規定する分⼦メカニズムの解明
- ② 化学物質曝露による神経発達毒性の評価系構築
- ③ 学習能⼒におけるアミノ酸代謝の役割
- ④ 学習能⼒と神経可塑性の連関解析
- ⑤ ゲノム編集による新規系統の創出
- ⑥ ⾼学習能以外の新たな表現型の探索と応⽤
2. がん転移メカニズムの解明とバイオマーカー探索
がんの死亡原因の多くは「転移」によるものです。
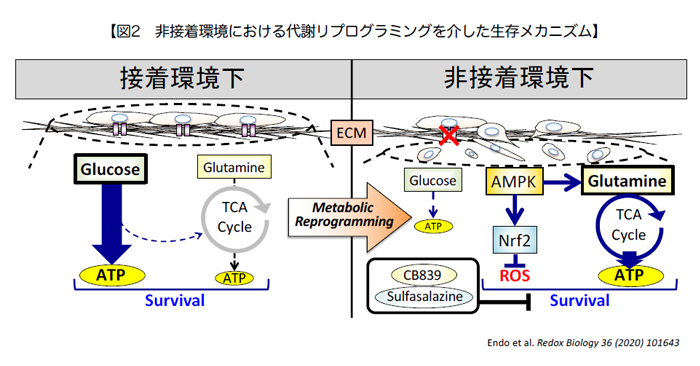
がん細胞は、原発巣から脈管内に侵⼊し、⾎流やリンパ流を通じて他臓器に到達・定着することで転移を起こします。この過程では、「接着の喪失」や「酸化ストレス」といった極限環境への適応⼒が求められます。
通常の細胞は、接着環境を失うと活性酸素が過剰に発⽣し、細胞死に⾄ります。ところが、がん細胞はこのストレスに巧みに適応する能⼒を獲得し、⽣き延びて遠隔臓器へと広がります。このプロセスに関わる分⼦機構を理解し、その予測・制御を可能にするバイオマーカーや創薬標的の発⾒を⽬指しています。
代表的な研究テーマ:
- ① 接着・⾮接着環境におけるがん細胞の⽣存メカニズムの解析(図2)
- ② ⾮接着環境が引き起こす悪性形質(がん幹細胞様性)の獲得機構の解明
- ③ がん転移を早期に検出するバイオマーカーの探索
- ④ 臓器⾮依存的な転移メカニズムの理解と新規創薬戦略
- ⑤ 遠隔転移の評価モデルの開発
未来志向の共同研究に向けて
本研究室では、「化学物質による⽣体影響」、「⾼次脳機能」や「がん転移」といった複雑な⽣命現象を、分⼦・細胞・個体レベルの統合的視点から捉える研究を展開しています。
環境と生命の接点を科学し、「予防につながる医学」を先取りするこの取り組みに共感していただける方との学際的な共同研究を歓迎しています。(研究代表者 遠藤)

















